Efectos de la N–acetilcisteína en los niveles séricos de podocalixina y pentraxina en un modelo experimental de lesión por ischemia–reperfusión en extremidades inferiores
Resumen
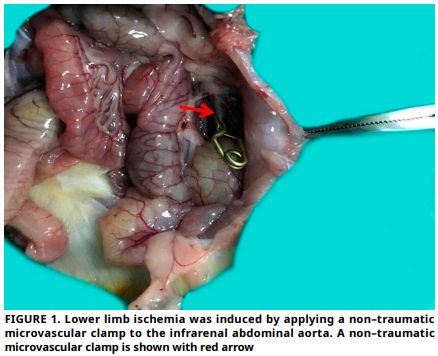
La lesión por isquemia–reperfusión provoca estrés oxidativo e inflamación, lo que conduce a daños en el músculo esquelético. Este estudio investiga el papel de la N–acetilcisteína en la modulación de biomarcadores de estrés oxidativo e inflamación, específicamente la podocalixina y la pentraxina 3, en un modelo de rata con lesión por isquemia–reperfusión en extremidades inferiores. Se realizó un estudio controlado en animales en el Centro de Investigación Experimental de la Universidad Firat. Veinticuatro ratas Sprague– Dawley hembras se distribuyeron en cuatro grupos: control, sham, isquemia–reperfusión y isquemia–reperfusión tratado con N–acetilcisteína. La ischemia se indujo mediante clampeo de la aorta abdominal infrarenal durante 120 min , seguido de 120 min de reperfusión. En el grupo de tratamiento, se administró una dosis única de N–acetilcisteína (150 mg·kg-1, intraperitoneal) al inicio de la reperfusión. Se evaluaron los niveles séricos de estado oxidativo total y estado antioxidante total, así como la expresión de podocalixina y pentraxina 3 en el tejido. En el grupo de isquemia– reperfusión, se observó un aumento significativo de los niveles de estado oxidativo total y una disminución significativa de los niveles de estado antioxidante total en comparación con el grupo control. Tras la administración de N–acetilcisteína, se observó una disminución significativa de los niveles de estado oxidativo total y un aumento significativo de los niveles de estado antioxidante total en comparación con el grupo isquemia–reperfusión. La evaluación histológica mostró que la N–acetilcisteína disminuyó el edema, la hemorragia y las puntuaciones generales de daño tisular. Los análisis inmunohistoquímicos revelaron un aumento de la expresión de podocalixina y pentraxina 3 en el grupo isquemia–reperfusión, la cual se redujo notablemente en el grupo tratado con N–acetilcisteína. La N–acetilcisteína demostró efectos protectores contra el daño oxidativo e inflamatorio inducido por isquemia–reperfusión en el músculo esquelético, reduciendo los niveles séricos y tisulares de podocalixina y pentraxina 3. Estos hallazgos sugieren su potencial terapéutico para mitigar la lesión por isquemia–reperfusión y destacan a podocalixina y pentraxina 3 como biomarcadores prometedores para el daño tisular y la monitorización del tratamiento.
Descargas
Citas
Ding S, Nie Y, Zhang X, Liu X, Wang C, Yuan R, Chen K, Zhu Q, Cai S, Fang Y, Chen Y, Mo D. The SNPs in myoD gene from normal muscle developing individuals have no effect on muscle mass. BMC Genet. [Internet]. 2019; 20(1):72. doi: https://doi.org/qjfb DOI: https://doi.org/10.1186/s12863-019-0772-6
Zhang Y, Li H, Wang M, Meng G, Wang Z, Deng J, Wang M, Zhang Q, Yang S, Jiang H. Vagus nerve stimulation attenuates acute skeletal muscle injury induced by ischemia– reperfusion in rats. Oxid. Med. Cell. Longev. [Internet]. 2019; 2019:9208949. doi: https://doi.org/gp5nz6 DOI: https://doi.org/10.1155/2019/9208949
Kalogeris T, Baines CP, Krenz M, Korthuis RJ. Cell biology of ischemia/reperfusion injury. Int. Rev. Cel. Mol. Biol. [Internet]. 2012; 298:229–317. doi: https://doi.org/f35x5z
Kerjaschki D, Sharkey DJ, Farquhar MG. Identification and characterization of podocalyxin—the major sialoprotein of the renal glomerular epithelial cell. J. Cell Biol. [Internet]. 1984; 98(4):1591–1596. doi: https://doi.org/bsnrk3 DOI: https://doi.org/10.1083/jcb.98.4.1591
Larrucea S, Butta N, Arias–Salgado EG, Alonso–Martin S, Ayuso MS, Parrilla R. Expression of podocalyxin enhances the adherence, migration, and intercel – lular communication of cells. Exp. Cell Res. [Internet]. 2008; 314(10):2004–2015. doi: https://doi.org/dnkf8x DOI: https://doi.org/10.1016/j.yexcr.2008.03.009
El–Ashmawy HM, Selim FO, Hosny TAM, Almassry HN. Association of serum podocalyxin levels with peripheral arterial disease in patients with type 2 diabetes. J. Diabetes Complicat. [Internet]. 2019; 33(7):495–499. doi: https://doi.org/qjfc DOI: https://doi.org/10.1016/j.jdiacomp.2019.04.003
Cieślik P, Hrycek A. Long pentraxin 3 (PTX3) in the light of its structure, mechanism of action and clinical implications. Autoimmunity [Internet]. 2012; 45(2):119–128. doi: https://doi.org/cc8cwh DOI: https://doi.org/10.3109/08916934.2011.611549
Kunes P, Holubcova Z, Kolackova M, Krejsek J. Pentraxin 3(PTX 3): an endogenous modulator of the inflammatory response. Mediators Inflamm. [Internet]. 2012; 2012:920517. doi: https://doi.org/f99zvs DOI: https://doi.org/10.1155/2012/920517
Bottazzi B, Inforzato A, Messa M, Barbagallo M, Magrini E, Garlanda C, Mantovani A. The pentraxins PTX3 and SAP in innate immunity, regulation of inflammation and tissue remodelling. J. Hepatol. [Internet]. 2016;64(6):1416–1427. doi: https://doi.org/f8mr9m DOI: https://doi.org/10.1016/j.jhep.2016.02.029
Abedini–Bajgiran F, Khazaei–Koohpar Z, Salehzadeh A. Effects of N–Acetylcysteine supplementation on oxidative stress and expression of apoptosis–related genes in testicular tissue of rats exposed to Lead. Biol. Trace Elem. Res. [Internet]. 2023;201(5):2407–2415. doi: https://doi.org/qjfd DOI: https://doi.org/10.1007/s12011-022-03325-0
Saricaoglu F, Dal D, Salman AE, Atay OA, Doral MN, Salman MA, Kilinç K, Aypar U. Effect of low–dose N–acetyl–cysteine infusion on tourniquet–induced ischaemia–reperfusion injury in arthroscopic knee surgery. Acta Anaesthesiol. Scand. [Internet]. 2005; 49(6):847–851. doi: https://doi.org/c34f7w DOI: https://doi.org/10.1111/j.1399-6576.2005.00722.x
Debruin EJ, Hughes MR, Sina C, Lu A, Cait J, Jian Z, Lopez M, Lo B, Abraham T, McNagny KM. Podocalyxin regulates murine lung vascular permeability by altering endothelial cell adhesion. PLoS One [Internet]. 2014; 9(12):e116613. doi: https://doi.org/qjfh DOI: https://doi.org/10.1371/journal.pone.0116613
Chen Q, Wang Y, Li Y, Zhao M, Nie G. Serum podocalyxin is significantly increased in early–onset preeclampsia and may represent a novel marker of maternal endothelial cell dysfunction. J. Hypertens. [Internet]. 2017; 35(11):2287–2294. doi: https://doi.org/g4g8wh DOI: https://doi.org/10.1097/HJH.0000000000001461
Yorganci A, Halici–Ozturk F, Hancerliogullari N, Çandar T, Caglar AT, Ozgu–Erdinc AS. The role of serum podocalyxin levels in recurrent pregnancy loss. Eur. J. Obstet. Gynecol. Reprod. Biol. [Internet]. 2021; 260:114–117. doi: https://doi.org/qjfj DOI: https://doi.org/10.1016/j.ejogrb.2021.03.021
Du Clos TW, Mold C. Pentraxins (CRP, SAP) in the process of complement activation and clearance of apoptotic bodies through Fcγ receptors. Curr. Opin. Organ. Transplant. [Internet]. 2011; 16(1):15–20. doi: https://doi.org/c2n6z7 DOI: https://doi.org/10.1097/MOT.0b013e32834253c7
Zhu H, Cui D, Liu K, Wang L, Huang L, Li J. Long pentraxin PTX3 attenuates ischemia reperfusion injury in a cardiac transplantation model. Transpl. Int. [Internet]. 2014; 27(1):87–95. doi: https://doi.org/f5k7pk DOI: https://doi.org/10.1111/tri.12197
Souza DG, Amaral FA, Fagundes CT, Coelho FM, Arantes RM, Sousa LP, Matzuk MM, Garlanda C, Mantovani A, Dias AA, Teixeira MM. The long pentraxin PTX3 is crucial for tissue inflammation after intestinal ischemia and reperfusion in mice. Am. J. Pathol. [Internet]. 2009;174(4):1309–1318. doi: https://doi.org/dmx3f3 DOI: https://doi.org/10.2353/ajpath.2009.080240
Lech M, Römmele C, Gröbmayr R, Eka–Susanti H, Kulkarni OP, Wang S, Gröne HJ, Uhl B, Reichel C, Krombach F, Garlanda C, Mantovani A, Anders HJ. Endogenous and exogenous pentraxin–3 limits postischemic acute and chronic kidney injury. Kidney Int. [Internet]. 2013; 83(4):647–661. doi: https://doi.org/qjfk DOI: https://doi.org/10.1038/ki.2012.463
Shimizu T, Suzuki S, Sato A, Nakamura Y, Ikeda K, Saitoh S, Misaka S, Shishido T, Kubota I, Takeishi Y. Cardio–protective effects of pentraxin 3 produced from bone marrow–derived cells against ischemia/reperfusion injury. J. Mol. Cell. Cardiol. [Internet]. 2015 ;89:306–313. doi: https://doi.org/f75rmq DOI: https://doi.org/10.1016/j.yjmcc.2015.10.013
Hortu I, Ilgen O, Sahin C, Akdemir A, Yigitturk G, Erbas O. Losartan ameliorates ovarian ischaemia/reperfusion injury in rats: an experimental study. J. Obstet. Gynaecol. [Internet]. 2020; 40(8):1148–1154. doi: https://doi.org/qjfm DOI: https://doi.org/10.1080/01443615.2019.1701639